第二章单元测试题
可可以用到的相对原子水平:N-14 O-16 C-12 H-1 Cl-35.5
1、选择题(每空 2 分,共 40 分)
1. 饼干开袋后渐渐变软,说明空气中含有( )
A. 二氧化碳 B. 氧气 C. 氮气 D. 水蒸气
2. 富氧炼钢会用到富氧空气,富氧空气中氧气与其他气体的体积比可能是( )
A. 1:3 B. 1:4 C. 1:5 D. 21:79
3. 钨酸钙 是白钨矿的主要成分,其中钨元素的化合价是( )
A. -6 B. +4 C. +6 D. +7
4. 含有两种原子团的化合物是( )
A. ZnSO4 B. Fe 3 C. NH4 NO3 D CaCO3
5. 有关分子、原子的认识正确的是( )
A. 相同原子能构成不同类型的分子 B. 原子是最小的微粒,不可再分
C. 分子水平肯定比原子水平大 D. 固体难压缩,说明固体分子间无间隙
6. 对以下三个化学反应的剖析正确的是( )
C+O ¾点¾燃¾® CO2 4P+5O2 ¾点¾燃¾® 2P2O5 CH4+ 2O2¾点¾燃¾® CO2+ 2H2O
A. 都是化合反应 B. 生成物均是气体 C. 都是氧化反应 D. 反应时均产生蓝色火焰
7. 化学方程式是描述化学反应的用语之一,以下化学方程式书写正确的是( )
A. Ca 2 + CO2 ® CaCO3 ¯ +H2O B. 2NaOH+CuSO4 ® Na 2SO4 + Cu 2 ¯
C. 4Fe+3O2 ® 2Fe3O4 D. 2KClO ¾M¾nO¾2 ® 2KCl+3O
8. 实验室中下列药品存放规范的是( )
9. 氧气的化学性质比较活泼,下列对有关反应的描述正确的是( )
A. 硫在氧气里燃烧,发出明亮蓝紫色火焰,生成无色无味的气体
B. 镁在氧气中燃烧发白光
C. 细铁丝在氧气中剧烈燃烧,火星四射,生成黑色的三氧化二铁
D. 物质与氧发生的反应是氧化反应,氧气具备氧化性
10. 对下列各符号中“3”所表示的意思,其说法不正确的是( )
A. 3H—表示三个氢原子 B. SO3 —表示一个三氧化硫分子中含有三个氧原子
C. 3H2 —表示三个氢分子 D. Al3+—表示铝元素的化合价为+3
11. 下列有关物质的性质和作用与功效说法不正确的是( )
A. 二氧化碳用于灭火,是借助它的物理性质和化学性质
B. 氮气用来保护粮食,是借助氮气常温下化学性质稳定
C. 稀少气体充入霓虹灯,是借助稀少气体通电能发出不同颜色的光
D. 氧气用于火箭发射,是借助稀少气体通电能发出不同颜色的光
12. 在设计实验“探寻常温下能加速过氧化氢分解的物质,并通过实验比较它们的成效”的过程中,设计了 以下实验装置,在两两对比实验中,下列察看(或测定)办法最难比较样品对过氧化氢加速成效的是( )

A. 第一组是同时实验,察看比较反应过程中两个气球体积的变化状况
B. 第二组是同时实验,察看比较反应过程中两者产生气泡的快慢
C. 第三组是分两次实验,看木条是不是能复燃
D. 第四组是分两次实验,比较反应过程中采集肯定体积的气体所需要的时间
13. 通过化学反应不可以生成的是( )
A. 新原子 B. 新分子 C. 新物质 D. 新单质
14. 作为相对原子水平标准的 1 个碳原子的水平是1.993 ´10-26 kg,一种氢原子 1 个原子的水平为
3.348 ´10-27 kg,则该氢原子的相对原子水平为( )
A. 1 B. 2 C. 3 D. 4
15. 1g 氮气含有 n 个 N2 分子,则阿佛加德罗常数可表示为( )
A. n B. n C. 14n D. 28n
16. 已知某氮的氧化物中,氮、氧两种元素的水平比为 7:20,则该物质化学式为( )
A. NO B. N2 O C. NO2 D. N2O5
17. 某校兴趣小组将课本“测定空气中氧气的含量”实验装置甲改进为实验装置乙,以下评价不适合的是
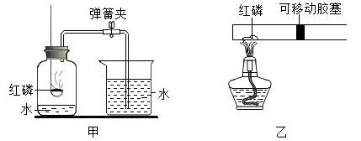 ( )
( )
A. 乙装置简洁,但用甲装置实验结果误差更小 B. 甲、乙两装置实验前都要检查装置的气密性 C. 乙装置实验中胶塞先向右移动,后向左移动
D. 乙装置中反应容器体积小,可以节省实验药品
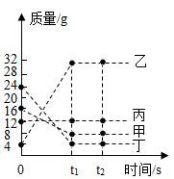 18. 在一密闭容器中加入甲、乙、丙、丁四种物质,在肯定条件下发生化学反应,测得反应前及 t1 、 t2 时 各物质水平如图所示,下列说法中不正确的是( )
18. 在一密闭容器中加入甲、乙、丙、丁四种物质,在肯定条件下发生化学反应,测得反应前及 t1 、 t2 时 各物质水平如图所示,下列说法中不正确的是( )
A. 该反应为化合反应
B. 丙可能为该反应的催化剂
C. 该反应中,乙、丁的水平变化之比为 7:5
D. 该反应中,甲、乙的水平变化之比为 1:4
19. 某化工厂进行电解食盐水的生产,则电解食盐水不可以制得的物质是( )
A. 氢氧化钠(NaOH) B. 氢气( H2 ) C. 二氧化碳( CO2 ) D. 氯气( Cl2 )
20. 有 CO、 CO2 和 N2 组成的混合物,已知混合物中碳元素的水平分数为 24%,则 N2 的水平分数可能是
( )
A. 8% B. 12% C. 30% D. 44%
2、填空题(共 60 分)
1. 化学有我们的语言,可以用国际通用的符号来表示物质的组成和变化。
(1)元素符号是最基本的化学语言。硅的元素符号是____________________,汞的元素符号是____________________
(2)写出下列化学式。
式量最小的物质____________________,引起温室效应的物质是______________________________,硫酸亚铁____________________,氯化银____________________,氧化 铝____________________,碳酸钾______________________________,酒精____________________
(3)写出化学方程式。
磷在空气中燃烧____________________
![]() 氢氧化钠溶液中滴加盐酸
氢氧化钠溶液中滴加盐酸
![]() 碳完全燃烧
碳完全燃烧
(4)在宏观、微观、符号之间打造联系,是化学学科特有些思维方法。
①氦气、水、干冰三种物质中由原子直接构成的物质是____________________(填化学式)。
②科学家屠呦呦因革新新型抗疟疾—青蒿素(化学式是 C15H22O5 )和双氢青蒿素(化学式是 C15H24O5 ) 的贡献,获得 2015 年度诺贝尔奖。该两种物质都是由____________________种元素组成的,每摩尔分子都约含有
____________________个氧原子。等物质的量的这两种物质中氢元素的水平比____________________。青蒿素的摩尔
水平为____________________,其中氢、碳元素的物质的量比为____________________。
2. 现有下列物质①液氧②自来水③硫粉④氯化钠⑤二氧化硫⑥洁净的空气。其中是单质的是____________________; 是化合物的是____________________;是氧化物的是____________________(填序号)。
3. 某课外活动小组的同学用下列装置探究氧气的实验室制法。

(1)写出图中标号的仪器名字:a____________________;b____________________
(2)实验室用氯酸钾制取氧气应使用的发生装置是____________________(填序号),写出反应的化学方程式
____________________。装置 F 可用于向上排气法采集氧气,气体应从导气管口____________________进入。
(3)该小组同学用 B 装置操作顺序:
①装药品。假如没说明用量时,固体药品应取____________________
②连接仪器,固定试管。一套复杂装置连接的顺序是____________________;试管口略向下倾斜是什么原因
![]() ③加热
③加热
④采集气体。若要得到干燥的氧气,则选择的采集装置为____________________(填编号),用该装置采集后,可以采取
____________________来证明氧气已经采集满了。若要得到纯净的氧气,则选择的采集装
置是____________________(填编号) 实验剖析:请帮助她找出上述实验过程中漏掉的一个实验步骤____________________
(4)若氧气采集完成后,测得其纯度明显偏低,缘由可能是____________________(填序号)
Ⅰ.氯酸钾中加入了二氧化锰 Ⅱ.采集前,集气瓶中未注满水 Ⅲ.采集后,集气瓶中仍有少量水 Ⅳ.未见气泡连续均匀冒出时就开始采集
![]()
 4. 从分子、原子的角度认识化学反应是化学研究的基本办法,如图是某密闭容器中物质变化过程的微观示 意图(“
4. 从分子、原子的角度认识化学反应是化学研究的基本办法,如图是某密闭容器中物质变化过程的微观示 意图(“![]() ”表示氧原子,“ ”表示氢原子):
”表示氧原子,“ ”表示氢原子):
请回答:
①变化Ⅰ中元素的存在形态发生变化的是____________________(填元素符号)。生成物的分子个数比与____________________(填
“水平”或“物质的量”)之比相等
②变化Ⅰ中的过程中,没发生变化的最小微粒是____________________(填微粒名字)
③下列关于变化Ⅱ的说法中,正确的是____________________(填写序号)
A. 分子的化学性质没改变 B. 分子变小了
C. 分子间的距离变小了 D. 分子的类型发生了改变
④从变化Ⅱ的微观过程可剖析出,该变化过程的一条宏观信息是____________________
![]()
![]() ⑤已知“
⑤已知“![]() ”的相对原子水平是“ ”的 m 倍。则参加反应的 和
”的相对原子水平是“ ”的 m 倍。则参加反应的 和![]() 的水平比为____________________
的水平比为____________________
5. 某物质 1.6 克在空气中充分燃烧生成 4.4 克二氧化碳和 3.6 克水,则该物质的化学式为____________________
6. 在一次实验操作考察时,教师拟定了四个考签:① O2 的制取;②配制 50g10%的 NaCl 溶液;③粗盐提
纯。每一个同学抽取一个考签进行实验
Ⅰ 甲同学抽签后来到实验室,发现本组实验桌上筹备了下列仪器和药品:

甲同学抽到的考签应该是________________________________________填实验序号),该实验的原理为______________________________用化学方程式表示), 二氧化锰有哪些用途____________________,可使用的仪器组合有____________________(填字母代号)
Ⅱ 乙同学抽到“配制 50g10%的 NaCl 溶液”。通过计算,需称量 NaCl______________________________g,量取水需要选取的适合量 筒是____________________(填“10mL”或“50mL”或“100mL”)
Ⅲ 丙同学抽到的考签为粗盐提纯

请依据实验回答下列问题:
通过操作②可以将____________________离别,在进行过滤时,可使过滤速度加快,滤液又不会损失的操作可能 是____________________ 。若提纯所得 NaCl 晶体的水平比实质值偏低,则可能的 缘由是__________
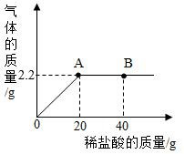
7. 向盛有 10g 大理石的锥形瓶中渐渐滴加 40g 未知浓度的盐酸溶液,生成气体的总水平与滴入盐酸溶液的 水平关系如图所示,求 40g 盐酸溶液中所含 HCl 物质的量____________________(依据化学方程式列式计算)
参考答案
1、选择题
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
D |
A |
C |
C |
A |
C |
B |
D |
BD |
D |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
20 |
D |
C |
A |
B |
D |
D |
A |
D |
C |
C |
2、填空题
1.(1)Si;Hg
(2)H2;CO2;FeSO4;AgCl;Al2O3;K2CO3;C2H6O
(3)4P+5O2 ¾点¾燃¾® 2P2O5;NaOH+HCl→H2O+NaCl;C+O2 ¾点¾燃¾® CO2
(4)①He ②3;3.01×1024;11:12;282g/mol;22:15
2. ①③;④⑤;⑤
3.(1)锥形瓶;试管
![]() (2)2KClO3 ¾M¾nO¾2 ® 2KCl+3O2↑;c
(2)2KClO3 ¾M¾nO¾2 ® 2KCl+3O2↑;c
(3)①盖满试管底部 ②从下到上,从左到右 ④D、F;将带火星的木条放在集气瓶口,木条复燃;C; 检查装置气密性
(4)II、IV
4. ①O、H;物质的量 ②氧原子、氢原子 ③A、C ④温度减少,分子间隙变小 ⑤2:m
5. CH4
6.I ①;2H2O2 ¾M¾nO¾2 ® 2H2O+O2↑;催化用途;ACEF 或 AGC II 5;50mL
III 混合溶液中的杂质与溶液;用玻璃棒导流;过滤时液面高于滤纸边缘等
7. 0.2mol







